腸内細菌叢(そう)バンク「J-Kinsoバンク」とは、便を提供いただける「腸内細菌ドナー」を募集、スクリーニングし、「腸内細菌叢移植」を行う際に患者さんに移植する腸内細菌叢溶液を調製し、医療機関に届ける仕組みです。「J-Kinsoバンク」は、腸内細菌を用いた医薬品の研究開発の基盤ともなります。
腸内細菌と様々な疾患の関連
人間の腸には約40兆個*1の「腸内細菌」が存在するといわれています。
近年の研究により、腸内細菌の乱れ(ディスバイオーシス)は、がん、潰瘍性大腸炎、パーキンソン病、アレルギーなど、さまざまな疾患と関連*2することが明らかになっています。
例えば、大腸がんは、食物繊維を多く摂取することで発症リスクが低下することが示唆されており、腸内細菌が関与している可能性がある疾患の一つです。近年の研究では、大腸がんと関連の強い腸内細菌の種類も特定されています*3。
また、潰瘍性大腸炎の発症の原因の一つが、腸内細菌叢の乱れであることも、明らかになっています*4。
喘息、食物アレルギーなどのアレルギー疾患も、腸内細菌叢の乱れとの関連を示唆する研究データが報告されています*5,6。
腸内細菌叢移植(FMT)について

腸内細菌に関する研究の進展とともに、世界では、腸内細菌を「医療」において活用する動きが広がっています。
腸内細菌叢移植(FMT)とは、健康な人の便に含まれている腸内細菌叢を、疾患を持つ患者さんの腸に移植し、バランスのとれた腸内細菌叢を再構築する治療方法です。
欧米では難治性クロストリジオイデス・ディフィシル感染症(rCDI)の治療を目的としたFMTが広く行われています。最新の報告では、米国において年間約48,000件*7、ヨーロッパでは約12,400件*8のFMTが行われていると推定されており、今後この治療の認知が向上し社会基盤が確立すれば更に需要は高まると言われています。
また、2022年には、米国とオーストラリアで、ヒトの便由来の腸内細菌による医薬品(難治性 C. diff感染症治療薬)が世界で初めて承認されました*9,10。臨床研究においては、腸内細菌をカプセル化した経口薬で、潰瘍性大腸炎に対する有効性を示した結果も報告されています *11。
日本では 難治性クロストリジオイデス・ディフィシル感染症(rCDI)に対するFMTは先進医療B「再発性Clostridioides difficile関連下痢症・腸炎に対する糞便微生物叢移植」として2020年に厚生労働大臣によって承認されています。更に、世界に先駆けて2014年から順天堂大学において臨床研究が始まった潰瘍性大腸炎に対するFMTが、2023年に先進医療B「アモキシシリン、ホスホマイシン及びメトロニダゾール経口投与並びに同種糞便微生物叢移植の併用療法」として承認を得て、社会実装へ向けた有効性・安全性の検証が進んでいます。
腸内細菌叢バンク「J-Kinsoバンク」について
メタジェンセラピューティクスは、腸内細菌叢移植に用いられる腸内細菌叢溶液の調製や医薬品の開発の基盤となる腸内細菌叢バンク「J-Kinsoバンク」を運用しています。
腸内細菌叢溶液の調製や医薬品の開発においては、「安全性」がとても重要となります。そのため、ドナー候補者の方に多くの適格性検査を受けていただく必要があります。ウェブ問診を受けてくださった方のうち、適格性検査を通過し最終的に「腸内細菌ドナー」としてご登録いただける方は、約10%と推定されています*12。
腸内細菌叢バンク「J-Kinsoバンク」の仕組み
メタジェンセラピューティクスでは、以下のような仕組みで「J-Kinsoバンク」を運用しています。
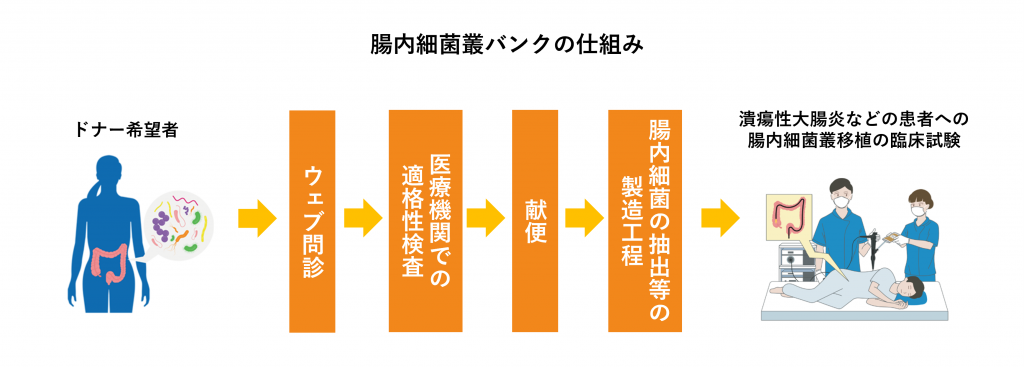
- ウェブ問診…腸内細菌ドナーに志願いただいた方に対して、「ウェブ問診」を実施します。「ウェブ問診」を通過された方に、「腸内細菌ドナー候補者」としてご登録いただきます。
(※腸内細菌ドナーとしての適格性は、「ウェブ問診」と、任意でお受けいただく「腸内細菌叢検査」の結果より、総合的に判断されます。)
- 医療機関での適格性検査…「腸内細菌ドナー候補者」に対して、地理的条件などを踏まえさらに審査を行います。審査を通過された方に、医療機関での適格性検査をご案内します。医療機関での適格性検査を通過されましたら、正式に「腸内細菌ドナー」としてご登録いただきます。
- 献便(便の提供)…「腸内細菌ドナー」としてご登録いただいた方に、順天堂大学医学部附属順天堂医院内の所定の場所にて「献便」を行っていただきます。
- 腸内細菌叢溶液の抽出等の製造工程…便から腸内細菌叢溶液を分画し、特性試験・スクリーニングにより、安全性・有効性を確保します。
諸外国における腸内細菌叢バンク
米国における腸内細菌叢バンク
米国では上記の通り、年間約48,000件のFMTがrCDI治療目的で使われていると推定されいます。かつての腸内細菌叢溶液の最大の提供者はOpenBiomeという非営利団体の腸内細菌叢バンクで、2019年には年間11,000件のFMTを全米に提供しました*13。OpenBiomeは現在ミネソタ大学腸内細菌治療プログラムと連携してCDI治療目的のFMTを提供し続けています。この連携はFMT製剤であるRebyota (フェリングファーマ)が市場に行き渡るまで継続される予定です。
豪州における腸内細菌叢バンク
豪州(オーストラリア)では長年rCDI治療目的のFMT提供が進められています。例えばCenter for Digestive Disease (シドニー)ではこれまで12,000件を超えるFMTが実施されてきています*14。2022年にはFMTを生物由来製剤 (Biologiacals) とする法整備も進み、医薬品としてFMTを展開する社会的な仕組みが最も進んでいる国の一つとなっています。
腸内細菌ドナーになるには
「腸内細菌ドナー」として献便を行っていただくにあたっては、まずドナー候補者登録のためのウェブ問診をお受けいただく必要があります。
●「腸内細菌ドナー候補者」としてご登録いただける方
・18歳以上65歳以下の日本国内在住で、健康状態が良好な方の健康な方
・腸内細菌医療支援のために献便にご協力いただける意思のある方
・適格性判定のためのウェブ問診を通過された方
※登録条件に関する詳細はこちら
個人情報の取り扱いについて
メタジェンセラピューティクスのプライバシーポリシーについては、以下をご覧ください。
出典:
1. Sender, R., Fuchs, S. & Milo, R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 14, e1002533 (2016)
2. Sorbara MT, Pamer EG. Microbiome-based therapeutics. Nat Rev Microbiol. 2022;20(6):365-380.
3. Okumura S et al. Gut bacteria identified in colorectal cancer patients promote tumourigenesis via butyrate secretion. Nature Communications. 2021 09 28; 12(1):5674
4. Kamada N, et al: Nat Rev Immunol, 13: 321-335, 2013
5. CHILD Study Investigators.: Sci Transl Med, 7: 307ra152, 201517:20
6. Ling Z, et al: Appl Environ Microbiol, 80: 2546-2554, 2014
7. Mamoon, L. & Olesen, S. W. Fecal Microbiota Transplants Annually and Their Positive Clinical Impact. Clin. Transl. Gastroenterol. 11, e00247 (2020)
8. Baunwall, S. M. D. et al. The use of Faecal Microbiota Transplantation (FMT) in Europe: A Europe-wide survey. The Lancet regional health. Europe 9, 100181 (2021)
9. FDA Approves First Fecal Microbiota Product, November 30, 2022
https://www.fda.gov/news-events/press-announcements/fda-approves-first-fecal-microbiota-product
10. BiomeBank announces world first regulatory approval for donor derived microbiome drug, November 9, 2022
https://www.biomebank.com/news/media-release/biomebank-announces-world-first-regulatory-approval-for-donor-derived-microbiome-drug/
11. Haifer C, Paramsothy S, Kaakoush NO, et al. Lyophilised oral faecal microbiota transplantation for ulcerative colitis (LOTUS): a randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol. 2022;7(2):141-151.
12. Bénard, M. V. et al. Challenges and costs of donor screening for fecal microbiota transplantations. PLoS One 17, e0276323 (2022)
13. https://openbiome.org/feature/openbiome-announces-new-collaboration-with-the-university-of-minnesota-to-treat-patients-with-recurrent-c-difficile-infections/
14. https://centrefordigestivediseases.com/about-us/professor-thomas-borody/
https://www.tga.gov.au/products/biologicals-blood-and-tissues-and-advanced-therapies/biologicals/faecal-microbiota-transplant-products-regulation

